QUÍMICA GRADO DÉCIMO
GASES IDEALES
diciembre 16 de 2019
Mapa de Navegación (dar clic para ver)
En la actualidad los estudiantes, muestran falta de interés y motivación hacia el estudio de las ciencias naturales, por relacionarse con contenidos numéricos, afortunadamente el auge de los RED, nos ofrece múltiples herramientas para abordar las temáticas de una manera distinta, con técnicas novedosas y amenas para ellos.
Es precisamente la inclusión de estos elementos en el diseño del presente blog, con lo que se pretende buscar el cambio de actitud de los estudiantes en este nivel, cuando están ad portas de ingresar a la educación superior y donde necesitan mucha fundamentación en las ciencias naturales.
Linea de tiempo (dar clic para ver)
Breve reseña histórica de los gases ideales
La historia del modelo de gas ideal se remonta al siglo 17, con los experimentos realizados por Robert Boyle, sobre el cambio de presión que experimentaba un gas cuando se variaba su volumen; posteriormente; Edme Mariotte de manera independiente llega a la misma conclusión pero añade que la temperatura debe mantenerse constante por lo que se denomina ley de Boyle - Mariotte.
El siguiente paso a la construcción de la teoría de los gases ideales lo dio Jacques Charles cuando obtuvo experimentalmente como cambiaba el volumen de un gas al variar su temperatura, manteniendo la presión constante.
Igualmente complementan esta teoría los trabajos realizados por Gay-Lussac en el siglo siguiente, cuando demuestra como varia la presión de un gas al variar su temperatura, manteniendo el volumen constante.
Video de gases
https://www.youtube.com/watch?v=SHiHS9DDgj0
DEFINICIÓN DE GASES IDEALES
Para definir un patrón de gas que sirva para establecer reglas de comportamiento se crea el concepto de gas ideal, este gas ideal cumple las condiciones siguientes:
1.- Ocupa el volumen del recipiente que lo contiene.
2.- Está formado por moléculas.
3.- Estas moléculas se mueven individualmente y al azar en todas direcciones a distancias considerablemente mayores que el tamaño de la molécula.
4.- La interacción entre las moléculas se reduce solo a su choque.
5.- Los choques entre las moléculas son completamente elásticos (no hay pérdidas de energía).
6.- Los choque son instantáneos (el tiempo durante el choque es cero).
Los gases reales, siempre que no estén sometidos a condiciones extremas de presión y temperatura, cumplirán muy aproximadamente las reglas establecidas para los gases ideales.
LEY DE LOS GASES IDEALES
Ley de Boyle - Mariotte
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. El volumen es inversamente proporcional a la presión: Si la presión aumenta, el volumen disminuye.
EJEMPLOS DE SITUACIONES PROBLEMA CON LA LEY DE BOYLE
PROBLEMA 1
Una muestra de nitrógeno ocupa un volumen de 3,8 litros a una presión de 1,3 Atmósferas. ¿Cuál será el volumen de nitrógeno ocupado a una presión de 1 Atmósferas?. La temperatura permanece constante
V1 = 3,8 Litros
P1 = 1,3 Atm
V2 = x
P2 = 1 Atm
P1 = 1,3 Atm
V2 = x
P2 = 1 Atm
Vemos que tenemos todos los datos, pero nos falta el V2 . Por lo tanto escribimos la ecuación y despejamos.
PROBLEMA 2
Un globo contiene un gas que ocupa 2,31 litros a una presión de 2 atm. Si la temperatura a la que se encuentra permanece constante. ¿Que presión ejercerá el gas en el globo si se lleva al volumen de 4 litros?.
Solución: Anotaremos los datos que nos da el problema.
V1 = 2,31 Litros
P1 = 2 Atm
V2 = 4 Litros
P2 = x
Vemos que tenemos todos los datos, pero nos falta el P2 . Por lo tanto escribimos la ecuacion y despejamos.
ACTIVIDAD # 1: SOBRE LA LEY DE BOYLE
Resuelva las siguientes situaciones problema.
1) En un recipiente cerrado de 4 Litros se introduce Oxigeno hasta que este ejerce una Presión de 2 Atmósferas. Calcular la Presión que ejercerá el gas si reducimos el volumen hasta 2 Litros.
2) Tenemos Nitrógeno gaseoso en un recipiente de 0,8 Litros, ejerciendo una presión de 1,23 Atmósferas. ¿Cual es la nuevo volumen si aumentamos la presión del gas hasta 2 Atmósferas?.
3) La presión del Nitrógeno gaseoso en un tanque de 12 Litros es de 15,65 atmósferas a 27 ºC. ¿Qué volumen ocupara el gas a 4,0 atmósferas , si la temperatura permanece constante ?
4) Una muestra de Cloro gaseoso ejerce una presión de 3 Atmósferas. Finalmente se incrementó la presión a 3,6 Atmósferas, reduciendo el volumen hasta 1,6 Litros. ¿Que volumen inicial posee la muestra de Cloro?
EXPERIMENTO SENCILLO SOBRE LEY DE BOYLE
APLICACIÓN DE LA LEY DE BOYLE
LEY DE CHARLES:
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la
temperatura de una muestra de gas a presión constante y, observó que cuando se
aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar
el gas, el volumen disminuía.
EJEMPLO DE SITUACIONES PROBLEMA CON LA LEY DE CHARLES
Análisis: Si nos dice, que es un gas sometido a presión constante, entonces estamos hablando de la Ley de Charles, para esa ley necesitamos dos cosas fundamentales, que serán nuestros datos, que son temperaturas y volúmenes.
Datos:
V1: El volumen inicial nos dice que son de 
T1: La temperatura inicial es de 69°C
T2: La temperatura final es de 13°C
Solución:
Para dar inicio a este problema, nos damos cuenta que lo que nos hace falta es el volumen final, o V2, para poder llegar a ello, solamente tenemos que despejar de la fórmula original y ver lo que obtenemos:
y aquí algo totalmente importante, y que coloqué de rojo texto atrás, Los problemas de Charles se trabajan en escala absoluta, es decir la temperatura debe estar en grados Kelvin, para ello no es gran ciencia, solo debemos sumar 273 a las temperaturas que tenemos en grados Celcius también conocido como centígrados, quedando de la siguiente forma,
Ahora solo nos queda reemplazar en la fórmula de la ley de charles , quedando lo siguiente:
Ahora podemos analizar, que mientras la temperatura baje, el volumen disminuirá.
Solución:
Analizamos el problema y lo que hacemos primero es reunir nuestros datos:
Sabiendo nuestra fórmula
despejamos 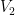
Reemplazando nuestros datos en la fórmula.
Por lo que podemos observar que el volumen final será de 2.306 litros, esto afirma nuevamente que mientras la temperatura disminuya, el volumen disminuirá.
Haciendo un resumen, debes considerar lo siguiente para enfrentar a problemas de las leyes de charles .
ACTIVIDAD SOBRE LA LEY DE CHARLES
Resolver los siguientes problemas
1. Una masa determinada de nitrógeno gaseoso ocupa un volumen de 4 litros a una temperatura de 31°C y a una presión de una atmósfera, calcular su temperatura absoluta si el volumen que ocupa es de 1.2 litros a la misma presión?
2. Se tiene un gas a una temperatura de 26°C y con un volumen de 90cm³ a una presión de 760 mm de Hg, ¿Qué volumen ocupará este gas a una temperatura de 0°C, si la presión permanece constante?
3. Una masa de oxigeno ocupa un volumen de 50cm³ a una temperatura de 18°C y a una presión de 640 mm de Hg, ¿Qué volumen ocupará a una temperatura de 24°C si la presión recibida permanece constante?
4. Calcular la temperatura absoluta a la cual se encuentra un gas que ocupa un volumen de 0.4 litros a una presión de una atmósfera, si a una temperatura de 45°C ocupa un volumen de 1.2 litros a la misma presión.
EXPERIMENTO SENCILLO SOBRE LA LEY DE CHARLES
APLICACIÓN DE LA LEY DE CHARLES
LEY DE GAY - LUSSAC
EJEMPLOS DE SITUACIONES PROBLEMA CON LA LEY DE GAY - LUSSAC
Solución: Si leemos detalladamente el problema nos podremos dar cuenta que las condiciones iniciales de temperatura y presión nos las dan como datos, al igual que la presión final, pero el único dato que no nos dan es la temperatura final, y la cual nos piden en °C.
Vamos a colocar nuestros datos:
He sumado a 35° la cantidad de 273, para poder hacer la conversión a grados Kelvin. Es muy importante que lo conviertan sino no dará el resultado que esperamos.
Ahora, usamos la fórmula para esta ley, la cual colocaré de nuevo.
Despejando a 
Nos queda
Ahora sustituimos nuestros datos.
Pero nos piden el resultado en °C, por lo que restaremos 273 a la cantidad resultante en grados Kelvin.
Como podemos observar en las condiciones iniciales del problema, la temperatura aumentó y como resultado también la presión, esto quiere decir que hemos resuelto el problema con éxito.
Veamos otro ejemplo:
Solución: Para este ejemplo podemos observar claramente que la variable que nos hace alta es la presión final, por lo que haremos una recopilación de nuestros datos y empezar a resolver.
Si hacemos el análisis también nos damos cuenta que la temperatura ha aumentado de 45°C a 125°C esto quiere decir que por la proporcionalidad que existe entre la presión y temperatura, la presión aumentará como resultado final, no sabemos en que cantidad, pero si sabemos que aumentará.
uy importante! y vuelvo a repetirlo, la temperatura siempre será en escala absoluta, es decir grados Kelvin.
Datos:
Por fórmula tenemos
Despejando 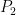
Nos queda
Reemplazando nuestros datos en la fórmula
Pero, para entenderlo mejor sigamos viendo un tercer ejemplo más
Solución: Anotemos los datos de nuestro problema y veamos las variables que tenemos y la que nos hace falta, recordemos mantener a la temperatura en su escala absoluta, por lo que tenemos que convertir a Kelvin.
Convertimos a la temperatura 1, en absoluta, quedando así:
Ahora, nos damos cuenta que nos hace falta la temperatura final, o T2, por lo que procedemos a realizar el despeje de la fórmula.
Sustituyendo en nuestros datos:
Por lo que la temperatura aumentó a 450°K, por lo que tiene lógica, ya que si vemos el aumento de la temperatura, se debe al aumento de la presión.
ACTIVIDAD SOBRE LA LEY DE GAY - LUSSAC
Resolver los siguientes problemas
1. Un gas produce una presión de 4 atmósferas a la temperatura de 47°C. ¿Qué presión produce a la temperatura de 127°C?
2.Una masa dada de gas en un recipiente recibe una presión absoluta de 7 atmósferas, su temperatura es de 57°C y ocupa un volumen de 300 cm³. Si el volumen del gas permanece constante y su temperatura aumenta a 95°C, ¿cuál será la presión absoluta del gas?
EXPERIMENTO SENCILLO DE LA LEY DE GAY - LUSSAC
APLICACIÓN DE LA LEY DE GAY - LUSSAC
RECAPITULEMOS LOS GASES IDEALES
REFERENCIAS BIBLIOGRÁFICAS
Características de los gases tomada de: https://www.youtube.com/watch?v=SHiHS9DDgj0
Ley de Boyle, tomada de: https://www.quimica-organica.com/ley-de-boyle/
Experimento sencillo ley de Boyle:https://www.youtube.com/watch?v=QldLPbf7k8U
Aplicacion Ley de Boyle: https://www.youtube.com/watch?v=RO8QHYbXVes
Experimento sencillo sobre ley de Charles: https://www.youtube.com/watch?v=lO4PqdFYom0
CVomic Gay Lussac: https://www.fisimat.com.mx/ley-de-gay-lussac/
Resoluccion de problemas Gay Lussac: https://www.fisimat.com.mx › ley-de-gay-lussac
Experimento sencillo Gay Lussac: https://www.youtube.com/watch?v=FRYP6GeG3nI
Aplicacion sencilla Gay Lussac: https://aprendecienciaytecnologia.com/2016/12/26/como-funciona-la-olla-a-presion/


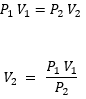
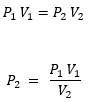








No hay comentarios.:
Publicar un comentario